2.1. INTRODUCTION
Les antibiotiques sont parmi les médicaments les plus utilisés mais aussi les plus mal utilisés (usage irrationnel).
La découverte du premier antibiotique, la Pénicilline a inauguré une nouvelle ère dans la pratique de la médecine : l’ère des antibiotiques qui a vu la résolution de l’épineux problème des infections en médecine générale et en chirurgie. Cependant, le large usage et le mésusage des antibiotiques ont contribué au développement et à la propagation des résistances microbiennes obligeant la communauté scientifique à découvrir continuellement de nouveaux antibiotiques.
Dans cette compétition dangereuse, les bactéries semblent avoir de l’avantage : En effet, il est relativement facile pour elles de développer les résistances ; les bactéries sont d’ailleurs aidées par les prescriptions intempestives, les administrations inappropriés, l’automédication et le mésusage. De l’autre côté, la découverte de nouveaux antibiotiques est couteuses, exigeante et peu sont les Firmes Pharmaceutiques qui de lancent dans cette aventure. Le monde est actuellement sous la menace des super bactéries, ces bactéries multi résistantes qui menacent de nous ramener à l’ère pré-antibiotique où toute infection entrainait trop souvent le décès. C’est d’ailleurs sous ce signe qu’a été placée la journée mondiale de la Santé de 2011 avec comme thème « Lutte contre la résistance aux antimicrobiens: pas d’action aujourd’hui, pas de guérison demain »

Face au développement des résistances et à la carence de nouveaux antibiotique, l’usage rationnel de antibiotiques apparait comme l’arme la plus efficace. Celui-ci s’appuie sur un certain nombre de principes notamment :
- Réserver les antibiotique aux infections don l’origine est bactérienne (prouvée ou suspectée)
- Respecter le plus possibles les doses qui devront être en mg/Kg chaque fois que possible
- Eviter autant que possible les antibiothérapies au long cours car le risque de développement des résistances est proportionnel à la durée de l’antibiothérapie.
- Conduire judicieusement l’antibiothérapie probabiliste en prenant en compte, le site infectieux, l’état du patient et la nature supposée du germe causal
- Recourir à la désescalade antibiotique, c’est-à-dire le choix de l’antibiotique au spectre le plus étroit lorsque l’agent causal de l’infection est connu (antibiogramme)
a. Définitions
- Antibiotique: Louis PASTEUR avait remarqué que certains microbes en culture avaient la capacité de produire des substances empêchant le développement d’autres microorganismes. Son élève VILLEMIN appela ce phénomène « antibiose » par opposition à la symbiose. De là, la dénomination « antibiotique » donné à ces substance ayant la propriété d’empêcher le développement des micro-organismes. Au départ, la définition ne s’appliquait qu’aux substances naturelles, souvent extraites de microorganismes (pénicilline, streptomycine…) (Waksman en 1942). Plus tard, cette définition a été élargie aux substances obtenues par hémi-synthèse ou synthèse complète ayant les mêmes propriétés (sulfamides).
Propriétés communes aux antibiotiques
- Activité antibactérienne ou antifongique
- Toxicité sélective: en ce sens qu’ils sont sensés agir à un niveau précis sur certaines structures ou réactions du métabolisme microbien en laissant indemne les cellules de l’hôte (différence par rapport aux antiseptiques)
- Actifs in vivo
- Pouvant être absorbés par et diffuser dans l’organisme Mais le terme le plus approprié est « antibactérien ».
- CMI: La concentration minimale inhibitrice est la concentration d’antibiotique la plus faible inhibant toute culture visible après 18 heures de culture à 37°C. Elle caractérise l’effet bactériostatique d’un antibiotique.
- CMB: La concentration minimale bactéricide est la plus petite concentration d’antibiotique laissant moins de 0,01% de survivants de l’inoculum initial après 18 heures de culture à 37°C. Elle caractérise l’effet bactéricide d’un antibiotique.
En présence d’un antibiotique bactériostatique, l’inoculum bactérien de départ ne diminue pas, il reste le même et parfois augmente un peu. C’est alors au système immunitaire de détruire les bactéries. Ceci explique pourquoi il est inutile et même dangereux de prescrire des bactériostatiques aux patients immunodéprimés ; leur système immunitaire ne joue pas son rôle et ne détruit pas les bactéries « maîtrisés » par l’antibiotique !!

- Infection: Elle se définit comme la pullulation de microorganismes dans l’organisme déterminant une réaction de celui-ci
On a ainsi deux camps en présence:
- Le germe: caractérisé par l’importance de son inoculum et sa virulence
- L’organisme: caractérisé par son immunocompétence
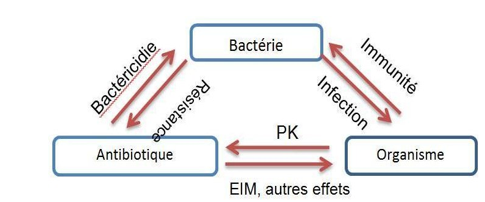
Trois camps au cours du traitement antibiotique (germe face au système immunitaire secondé par l’antibactérien). On a trois pôles d’interaction : la bactérie responsable de l’infection d’une part, le système immunitaire et enfin l’antibiotique
a. Origine des antibiotiques
- Antibiotiques naturels: Exemple : pénicilline, premier antibiotique à usage clinique, était produite par Penicillum notatum ; actuellement elle est plus facilement extraite de Penicillium chrysogeum
- Antibiotiques Semi-synthétiques: des modifications chimiques sont souvent apportées aux molécules naturelles pour améliorer l’activité et/ou modifier des paramètres
pharmacocinétiques essentiels. La plupart des antibiotiques en usage clinique sont obtenus par semi-synthèse
- Antibiotiques Synthétique: les progrès de la chimie ont permis de réaliser dans des conditions économiques satisfaisantes la synthèse totale de plusieurs antibiotiques: isoniazide, chloramphénicol actuellement…
b. Classification des antibiotiques
Les antibactériens sont classés en « familles » ou « groupes» Il existe plusieurs critères de classification :
- Classification selon leur structure chimique: sulfamides, polypeptides…
- Classification selon le mécanisme d’action :
- antibiotiques agissant sur ma paroi bactérienne (Bêta lactames…),
- inhibition de DNA gyrase : quinolones
- inhibition de RNA Polymérase (Rifampicine)
- ceux qui inhibent la synthèse des protéines en agissant au niveau des ribosomes (aminosides, cyclines, chlorampénicol),
- ceux qui perturbent le métabolisme des acides nucléiques (quinolones), et
- les antimétabolites (triétoprime ; sulfamides)
- Classification selon les bactéries cibles: antituberculeux, anti staphylococciques…
- Dans une même famille on peut trouver des Générations: céphalosporines de 1ère, 2ème génération…
La résistance bactérienne
La résistance aux anti-infectieux en général et aux antibiotiques en particulier est un des problèmes de santé des plus graves. Il s’agit d’un phénomène naturel lié à l’utilisation des anti- infectieux (les bactéries sont des êtres vivants; elles essaient de s’adapter au milieu hostile constitué par les antibiotiques). Mais ce phénomène est accéléré par l’usage excessif et inapproprié des antibiotiques.
A. Conditions d’efficacité des antibiotiques
Après qu’il a atteint le site de l’infection, un antibiotique sera efficace à trois conditions :
- Qu’il atteigne (en concentration active suffisante) une certaine cible sur la bactérie, les concentrations au site infectieux doivent être supérieures à la CMI/CMB. La quantité du médicament atteignant le site infectieux sera déterminée par ses propriétés Pharmacocinétique (PK) tandis que les caractéristiques et l’ampleur de l’effet obtenu seront déterminées par la Pharmacodynamie (PD). C’est ainsi que se développe la notion de « paramètres PK/PD » actuellement capitale pour l’usage optimale des antibiotiques (cfr conduite de l’antibiotherapie pour les détails).
- qu’il se lie à cette cible et
- modifie son fonctionnement.
B. Mécanismes de résistance bactérienne
La résistance des bactéries va jouer sur ces éléments. Trois mécanismes principaux de résistance bactérienne sont ainsi identifiés :
- Les bactéries peuvent empêcher l’antibiotique d’atteindre sa cible ;
- Ou bien modifier cette cible de façon à ce que l’antibiotique ne se fixe plus ;
- Ou encore empêcher l’antibiotique fixé de modifier le fonctionnement de la cible.
1. Empecher l’antibiotique d’atteindre sa cible
Par divers mécanismes, la bactérie peut empêcher la pénétration d’un antibiotique à travers sa membrane plasmique ou sa paroi externe.
- Par la présence de pompes qui chassent activement l’antibiotique hors de la bactérie : (résistance à la tétracycline, au chloramphénicol, aux fluoroquinolones, macrolides, et aux bêta-lactames)
- Par modification de la perméabilité membranaire à l’antibiotique : la cible de la gentamicine est au niveau des ribosomes. Pour atteindre les ribosomes bactériens, la gentamicine est activement transportée à travers la membrane grâce au gradient électrochimique généré par les enzymes respiratoires de la phosphorylation oxydative. Une modification de ce système ou des conditions d’anaérobie peuvent réduire la pénétration de la gentamicine et conduire à une résistance de la bactérie. Ceci explique l’inefficacité de cet antibiotique sur les germes anaérobies.
2. Modification de la cible :
Ceci se fait par mutation de la cible naturelle (résistance aux fluoroquinolones) ou modification de la cible (protection des ribosomes contre les macrolides ou la tétracycline), ou acquisition d’une forme résistance de la cible (Penicillin Binding Protein de faible affinité produite par les Staphylocoques résistants à le méthicilline)
3. Empêcher l’antibiotique de modifier la cible : Inactivation du médicament
Ceci se fait par production d’enzymes qui détruisent l’antibiotique (bêtalactamase par exemple) ou par ajout d’un radical qui rend l’antibiotique inefficace (inactivation du chloramphénicol par acétylation). Certains antibiotiques sont des pro-médicaments c’est-à-dire qu’ils sont inactifs mais sont transformés en métabolites actifs in vivo. Certaines bactéries développent leurs résistances en inhibant la transformation d’un pro-médicament en son métabolite actif (résistance du BK sur Isoniazide)
C. Acquisition de la résistance
Une bactérie ecquiert la résistance par mutation et sélection avec transmission du caractère résistant aux bactéries-filles ou par transmission horisontale d’une bactérie à une autre.
Mutation- sélection
Plusieurs facteurs interviennent pour créer des mutants au sein d’une population bactérienne. L’usage des antibiotiques joue ensuite en éliminant les souches sensible et laissant l’espace aux souches résistantes pour se développer. Une population bactérienne, au départ dominé par des souches sensibles devient ainsi progressivement dominée par les souches résistantes. Exemples : résistances à la streptomycine (mutation au niveau des ribosomes), aux quinolones (mutations au niveau de l’ADN gyrase ou la topo isomérase IV)
Transfert horizontal de gène de résistance
C’est un mécanisme très important ; il se fait par conjugaison. Par ce mécanisme, deux bactéries se lient par un pili. Il s’opère alors un transfert de matériel génétique notamment les plasmides. Plusieurs gènes de résistances peuvent être transmis par un seul contact. Ce procédé est utilisé surtout par les bacilles Gram négatifs. Quelques Gram positifs, comme les entérocoques et les staphylocoques utilisent aussi ce mécanisme.
